나파모스타트, 혈액 항응고제·급성 췌장염 치료제 성분
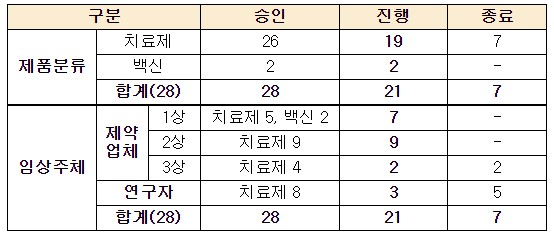
코로나19 치료제·백신 국내 임상시험 총 21건 진행 중
치료원리, 바이러스의 세포 진입 억제해 항바이러스 효능
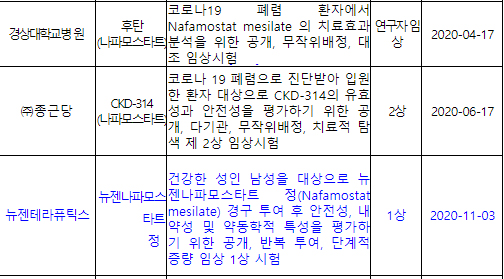
경상대병원·종근당(2상), 이 성분의 주사제로 임상시험 승인받아 진행 중
국내에서 개발되고 있는 뉴젠테라퓨틱스의 코로나19 치료제 '뉴젠나파모스타트정'에 대한 1상 임상시험이 지난 3일 승인됐다.
식품의약품안전처에 따르면 현재 국내 코로나19 관련 임상시험 중인 백신은 2건, 치료제는 19건으로 총 21건이다.
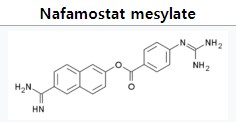
뉴젠나파모스타트정은 항응고제로 사용되는 성분인 나파모스타트메신산염(nafamostat mesilate)으로 주사제 대비 복용 편의성 개선을 위하여 정제로 투여경로를 변경해 개발되었다.
나파모스타트(Nafamostat)는 혈액 항응고제 및 급성 췌장염 치료제의 성분으로 일본 제약사 토이리에서 개발한 의약품으로 국내 제일약품이 작년 식약처를 통해 췌장염 치료제 나파코스타트의 생산 및 판매 제네릭 허가를 받아 판매하고 있다.
지난 5월 한국파스퇴르연구소는 ‘나파모스타트’가 코로나19 바이러스 감염을 억제하는 매우 강력한 항바이러스 효능을 가졌다고 밝힌 바 있다.
연구소는 세포배양 실험을 통해 분석한 약 3천여 종의 약물 중 코로나19 바이러스에 대한 가장 강력한 항바이러스 효능을 보였으며, 이는 미국에서 긴급사용 승인된 렘데시비르와 비교 시 수백 배 우수한 수준이라고 설명하기도 했었다.
나파모스타트는 렘데시비르 대비 600배 이상의 항바이러스 효과를 가진 것으로 알려졌으나, 체내에서 반감기가 짧아 병원에 방문해 수액 형태로 24시간 투약을 해야 하는 점이 단점으로 지적받아 왔다.
이번 임상은 건강한 성인 대상으로 내약성과 안전성 등의 평가를 위한 1상 임상시험이다. 내약성은 임상시험 대상자가 부작용이나 불편감을 견뎌낼 수 있는 정도를 의미한다.
1상 임상은 최초로 사람에게 투여해 안전성과 약동학 등을 평가하는 단계이다.
이번 임상의 치료원리는 바이러스의 세포 진입을 억제해 항바이러스 효능을 나타내는 방식이며, 국내에서 지난 4월부터 경상대학교병원이, 지난 6월부터 종근당(2상)이 같은 성분의 주사제로 임상시험을 승인받아 진행 중이다.
지난 10월15일 뉴지랩은 자회사 '뉴젠테라퓨틱스'가 코로나19 치료제 나파모스타트의 효능 지속기간을 기존 대비 3배 이상 증가시킬 수 있는 서방정형태의 제형 개발에 성공해 관련 특허 출원을 완료했다고 밝힌 바 있다.
뉴지랩은 코로나19 경증 환자들을 대상으로 타미플루처럼 집에서 간편히 복용 가능한 알약 형태의 나파모스타트 개발을 위해 지난 6월 특허 출원 이후 본격적으로 임상 준비를 진행해왔다.
한편, 4일 오후 3시 기준 존스 홉킨스 대학 집계에 따르면 전세계 코로나19 감염확진자는 4740만7200명을 넘어섰고, 총 사망자는 121만3744명을 기록했다.
이날 질병관리청에 따르면 국내 발생 신규 확진수는 98명이며, 해외유입 사례는 20명이다.
포인트경제 김수철 기자
- 국내 진행 중인 코로나19 임상시험...치료제 13건·백신 2건
- 코로나19 치료제·백신 개발 현황...임상 치료제 13건, 백신 2건
- '렘데시비르'보다 강력한 항바이러스 효과 '나파모스타트' 밝혀낸 국내 연구진
- 덴마크, 코로나19 돌연변이로 12명 감염...대규모 '밍크' 도살 예정
- 아스피린, 코로나19 치료에 효과 있을까?
- 화이자, "백신 3상 임상 90%이상 효과 나타내"...이미 백신 제조 시작
- [코로나19] 국내 개발 치료제 19건·백신 2건 현황...항체치료제 속도 빨라
- 모더나 코로나19 백신 임상시험 95% 효과...유통기한·안정성 향상
- 국내 개발 코로나19 백신 임상 1건 추가 승인...현재 총 3건 진행 중
- 코로나19 치료 후보물질 '안트로퀴노놀(ANQ)'은 어떤 성분인가?

