美 지난 2월 오염된 안약 인한 환자 81명, 사망자 4명 발생
지난 15일 FDA, 여러 브랜드 특정 안약 사용 금지 재경고
올해 점안액 오염이 급증한 원인
지난 2월 미국에서 오염된 안약으로 인한 안구 감염 사례로 녹농균 환자가 81명, 사망자가 4명이 발생한 바 있다. 일부는 영구적인 시력 상실까지 생겼다.

당시 미국 질병통제예방센터(CDC)와 식품의약국(FDA)은 'EzriCare'와 'Delsam Pharma'의 인공눈물 제품 리콜과 함께 소비자들의 사용을 중단하라고 경고했었는데, 최근 FDA가 다시 경고했다. 이유는 무엇일까?
지난 15일 FDA는 눈 감염 위험으로 인해 여러 주요 브랜드의 특정 안약을 구매하거나 사용하지 말라고 소비자에게 다시 한번 경고했다.
제조업체인 킬리치 헬스케어 인디아 유한회사(Kilitch Healthcare India Limited)는 이러한 제품에 대해 자발적인 리콜을 발표했으며, FDA는 목록에 있는 제품을 확인할 것을 권장했다.
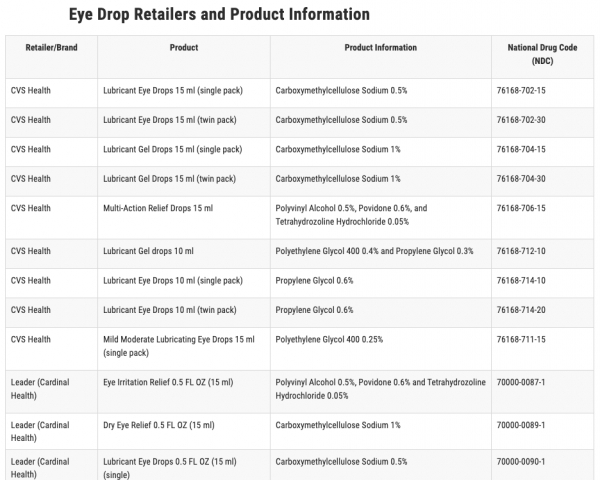
앞서 지난 3일에 카디널 헬스 주식회사(Cardinal Health Inc.)는 Leader 브랜드 안과용 제품 6개 전체에 대해 자발적인 리콜을 시작했다. FDA는 이들 확인된 제품들을 국가 의약품 코드(NDC)를 포함하도록 제품 목록을 업데이트했다.
FDA는 지난달 월마트(Walmart)가 매장과 온라인에서 판매하는 'Equate Hydration PF Lubricant Eye Drop 10 mL' 점안액을 포함하도록 소비자가 구매하거나 사용해서는 안 되는 일반 점안제 목록을 업데이트하고 있다고 밝혔다. 또한 부분적인 시력 상실 또는 실명을 초래할 수 있는 눈 감염의 잠재적 위험으로 인해 26가지 일반 점안제 제품을 구매하지 말고 즉시 사용을 중단하라고 소비자에게 경고했다.
다만, 11월 중순 현재 해당 제품으로 인한 눈 감염 사례는 보고되지는 않았다.
이번 FDA의 검사 결과 시설 내 비위생적 상태가 발견되었으며, 핵심 의약품 생산 지역의 환경 샘플링에서 양성 박테리아 테스트 결과가 나타났다. 그러나 박테리아 유형, 시설 내 출처, 발견된 오염 유형, 오염으로 이어지는 정확한 조건 또는 이 경고와 관련된 감염에 대한 구체적인 세부 정보는 2023년 11월 중순 현재 공개되지는 않았다.
이 최신 경고는 올해 초 보고된 오염된 안약에 대한 경고와 유사하다. 지난 2월의 발병의 원인은 비위생적인 조건과 오염된 안약으로 알려졌다. FDA는 미국에서 판매되는 점안제 제품을 만든 인도 제조 시설의 비멸균 조건에 대한 포괄적인 설명을 제공한 바 있다.
올해 점안액 오염이 급증한 원인과 잠재적 위험의 이유
지난 2월에 발생한 발병은 이전에 알려지지 않은 항생제 내성 박테리아가 미국 전역에 퍼지기 시작하면서 밝혀졌다. 연방 조사관은 오염된 안약 사용과 관련해 정교한 게놈 지문 채취 접근 방식을 사용했다고 한다.
미국에서 소비되는 의약품의 50% 이상이 해외에서 생산되지만, 코로나19 팬데믹이 최고조에 달하자 FDA는 국제 제조 시설에 대한 지속적인 검사를 대폭 축소했다. 감독 감소가 일시적이기는 했지만, 이로 인해 제품 오염이 확인되지 않았을 수도 있는 것으로 보고 있다.
또한 올해까지는 오염된 안약으로 인한 감염이 거의 발생하지 않았다. 초기 검사 중 제조 공정에서 발견된 눈에 띄는 무균 문제를 고려해 FDA가 추가 조사를 실시하고 더 많은 문제를 발견했으며 이로 인해 경고가 증가했을 수 있다는 것이다.
우리의 피부는 박테리아가 감염을 일으키는 것을 막는 장벽 역할을 하는 것처럼 우리 몸에는 자연 방어 시스템이 있다. 하지만 병원균을 함유한 점안액은 보호 장치를 우회에 저항성 박테리아를 눈의 취약한 환경에 직접 유입시킬 수 있고, 뿐만 아니라 기존 항생제로 치료하기 어려운 심각한 감염을 일으킬 수도 있다.
지난 2월 발병과 관련된 특정 균주인 녹농균(Pseudomonas aeruginosa)은 여러 항생제를 비롯해 일반적으로 최후의 수단으로 사용되는 항생제에도 놀라운 저항성을 나타냈다. 이러한 내성은 치료를 더 어렵게 만든다. 또한 오염된 점안액에는 방부제도 포함되어 있지 않아 오염 위험이 더욱 높아졌다고 알려졌다.
FDA는 오염 가능성이 있는 안구 제품 목록의 업데이트를 확인하고, 리콜 알림을 구독할 수 있고, 오염 위험이 있는 것으로 표시된 안약 브랜드의 구매를 피해야 한다고 밝혔다. 또한 점안약이나 일반의약품을 구입하기 전에 제품 라벨을 주의 깊게 읽는 것과 만료인과 경고, 사용지침을 확인하는 것이 필요하다고 설명했다.

한편, 국내에서 지난 7월 한미약품의 1회용 점안액 3품목이 3개월 제조정지 행정처분을 받은 바 있다. 식품의약품안전처에 따르면 해당 3품목은 한미약품의 ‘히알루미니점안액0.1%’ 및 ‘히알루미니점안액0.15%’(히알루론산나트륨), ‘디쿠아폴점안액3%(디쿠아포솔나트륨)’ 등이었다.
행정처분 사유는 한미약품이 이들 점안액 무균제제 작업실의 급기구 위치 변경 등 식약처장이 정해 고시하는 중요한 사항을 변경했음에도 GMP 적합판정을 다시 받지 않고 제조·판매했기 때문이라는 것이었다.
당시 한미약품은 “당시 변경했던 작업장은 이후 진행된 식약처 정기실사에서 ‘문제없음’으로 결정돼 현재 여러 고품질 제품이 생산되고 있다”라고 밝혔다. 그러면서 “과정이 어떻든 규제 당국의 입장과 결정을 존중한다”라며 “이번 행정처분 대상 품목은 품질과는 무관하다. 고품질 의약품 생산에 더욱 만전을 가하겠다”고 밝혔다.
지난 9월에는 대우제약(주) ‘토베손점안액’(수출명:필토베손점안액,덱스티어점안액에 판매업무정지 6개월 처분을 받았다. 처분 사유는 '의약품 동등성 재평가 자료 미제출(2차 위반)'이다.
포인트경제 김지연 기자

