㈜코젠바이오텍, 체외진단용 제품 정식 허가
국내 코로나19 진단시약, 전 세계 160여 개국에 총 3억4723만명분 수출

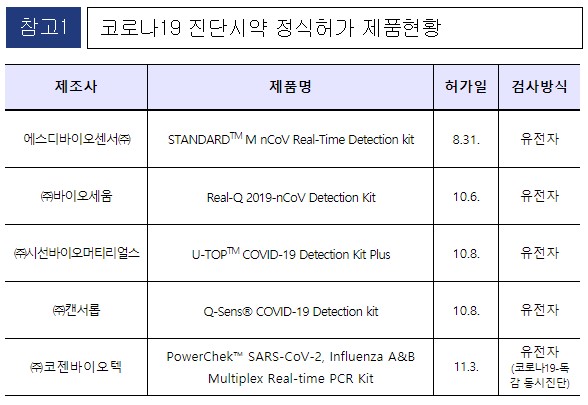
코젠바이오텍의 코로나19-인플루엔자 동시 진단시약 제품이 식품의약품안전처의 정식 허가를 받았다.
식약처는 지난 3일 (주)코젠바이오텍의 'PowerChek™ SARS-CoV-2, Influenza A&B Multiplex Real-time PCR Kit' 제품을 정식 허가한다고 밝혔다.
독감과 코로나19의 동시 진단이 가능한 이 제품은 체외진단용 유전자 검사방식 진단 시약이다.
기침이나 인후통, 발열 증상 등은 코로나19와 독감이 비슷해 구분이 쉽지 않은데 동시에 진단할 수 있는 이런 진단키트가 효과적일 것으로 기대되고 있다.
이 제품은 호흡기 감염증 의심 환자의 비인두 도말 검체에서 SARS-CoV-2 바이러스 유전자, A형 인플루엔자 바이러스 유전자, B형 인플루엔자 바이러스 유전자를 실시간 역전사중합효소연쇄반응법(Realtime RT-PCR)으로 정성 검출해 동시 진단에 도움을 주는 체외 진단의료기기이다.
의심 환자의 검체를 검사하는 경우 한 번의 검사로 3~6시간 이내에 진단결과를 동시에 얻을 수 있고, 검사 시간을 단축시켜 빠른 시간 내에 적절한 처치를 할 수 있게 된다.
이는 환자의 편의성과 의료인의 부담을 덜 수 있어서 큰 의미가 있다고 식약처는 밝혔다.
식약처가 코로나19 유전자 진단시약 5개 업체의 제품을 허가한 상황이며, 현재까지 정식허가를 신청한 진단시약은 유전자 진단시약 14개, 항원 진단시약 5개, 항체 진단시약 11개로 총 30개 제품이 심사 중에 있다.
코로나19 진단 시약 수출 현황
3일 기준 유전자 100개, 항원 27개, 항체 70개 등 197개 제품이 수출용 제품으로 허가되어 인도와 미국, 브라질, 인도네시아, 이탈리아, 네덜란드 등 전 세계 160여 개국에 총 3억4723만명분을 수출했다.
지난 9월까지 약 1조3956억원이 수출된 것으로 올해 코로나19로 인해 새롭게 창출된 수출 규모이다.
작년 체외진단시약 전체 수출액인 4855억원과 비교하면 187% 증가한 규모이며, 연말까지 200%를 상회할 것으로 예상되고 있다.
식약처는 신규 수출시장 개척은 국제적으로 인정받은 K-방역의 성과와 맞물려 국내 제품의 우수성이 원동력이 된 것으로 평가된다고 밝혔다.
포인트경제 박주현 기자
- 코로나19 진단시약 승인·허가현황...확진검사용 7개·응급선별용 9개·정식허가 1개
- 식약처, 질본의 응급용 코로나19 진단시약 긴급사용 3개 승인
- '밍크' 변종 코로나19 바이러스 공포...영국, 덴마크 여행 폐쇄
- FDA, 코로나19 가정용 진단키트 승인...면봉 넣은 용기 30분 후 결과
- 코로나19 국내 진단시약 9개 정식허가...170개국·5억만명분 수출
- 독감주사 2024만 건 접종 중 108명 사망...기저질환 악화 주원인
- 코로나 신속항원 진단키트 'MARK-B'...가나에 2만개 공급 계약
- [단독] 인도 첫 발견된 '토마토 독감', 원숭이두창 등 증세 유사...5세 미만 82명 진단
- 올여름 유난히 독감 유행 지속되고 있다

