광감각제에 독성 강화법으로 중금속 연결의 체내 부작용 문제 해결 위해
UNIST 권태혁 교수팀, 생체 무해한 나노젤 이용 광감각제 독성 조절 전략
정상세포서 독성 낮추고 암세포에선 강한 독성
화학 분야 권위지 '앙게반테 케미(Angewandte Chemie)' 게재
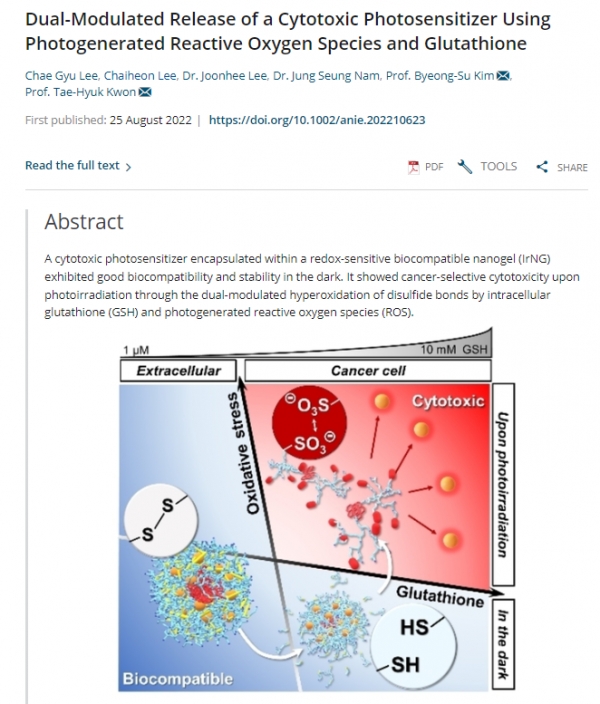
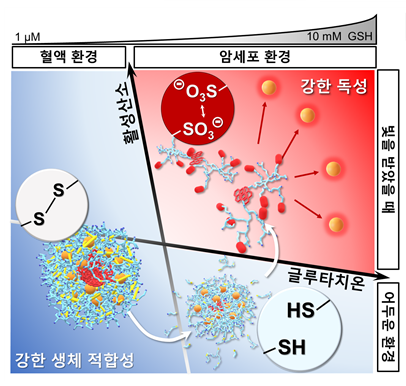
빛에 반응하는 물질인 광감각제(photosensitizer, 광활성에 의해 활성산소를 생성할 수 있는 물질)를 사용하는 차세대 암 치료법인 광역동 치료(photodynamic therapy, PDT). 빛을 받은 광감각제가 독성인 활성산소종(ROS, 산소 원자를 포함하는 화학적 반응성이 높은 분자)을 만들어내는데 강한 산화력으로 암세포 내부 산화-환원 균형을 망가뜨리는 원리를 이용한다.
이는 활성산소종 생성 효율에 결정되기 때문에 광감각제에 중금속을 도입하면 효율이 극대화되지만, 필연적으로 강한 소수성(疏水性, Hydrophobe, 물 분자와 쉽게 결합하지 못하는 성질)을 띠며, 중금속 자체 독성으로 낮은 수계 용해도와 세포 독성을 보이기 때문에 심각한 부작용을 초래할 수 있다.

15일 울산과학기술원(UNIST)은 생체에 무해하고 안정한 '나노젤(Nanogel)'을 이용해 체내 부작용을 줄인 시스템으로 광역동 치료를 안전하게 사용할 방법을 개발했다고 밝혔다. UNIST에 따르면 화학과 권태혁 교수팀이 정상세포 환경(혈액 환경)에서는 안정하게 항암제를 보관하고, 치료가 필요한 암세포 환경에서는 빛을 쪼이면 활성화돼 항암제를 방출하는 '나노젤 광감각제 시스템'을 개발했다.
이번 연구는 화학 분야 권위지인 ‘앙게반테 케미(Angewandte Chemie International Edition)’에 지난 12일 자로 게시됐다.
연구팀은 체내 부작용 문제를 해결을 위해 어떤 방법을 사용했을까.
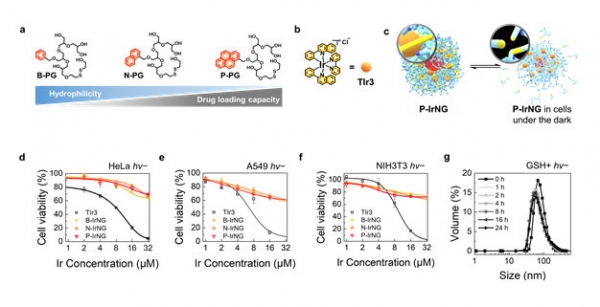
권 교수 연구팀은 물에 잘 녹으면서 적합한 '고분자 기반 나노젤'로 광감각제를 감싸는 방법을 사용했다.
산화-환원 안정적 자기가교결합으로 형성된 나노젤의 소수성 상호작용을 증가시켜, 나노젤 내부의 티올과 이황화결합을 계속 가까이 위치하게 했으며, 이를 통해 혈액이나 체액 대비 높은 환원성을 가지는 세포환경(정상세포와 암세포 모두)에서도 가역 반응의 활성화를 유도했다. 그 결과 빛을 주지 않는 어두운 조건에서는 나노젤이 높은 환원 조건에서도 안정적으로 광감각제를 담고 있음을 확인했다.
이채규(UNIST 화학과 석‧박통합과정, 제1저자) 연구원은 "원하는 부위에서만 광감각제의 독성이 보이는 것은 산화-환원 반응의 가역성과 나노젤의 소수성 상호작용을 이해하고 정밀하게 조절한 결과"라고 말했다.
정상세포(NIH3T3)와 암세포(HeLa, A549)는 빛이 없는 조건에서 광감각제(TIr3)만 투여한 결과와는 달리, 나노젤(IrNG)이 있는 조건에서 높은 생체 적합성(>70% cell viability)을 보였다. 또 동물 종양 모델에서도 빛이 없을 땐 대조군(PBS+hv-)과 종양 성장 속도가 비슷해, 광감각제가 담긴 나노젤은 생체 독성이 없음을 확인했다.
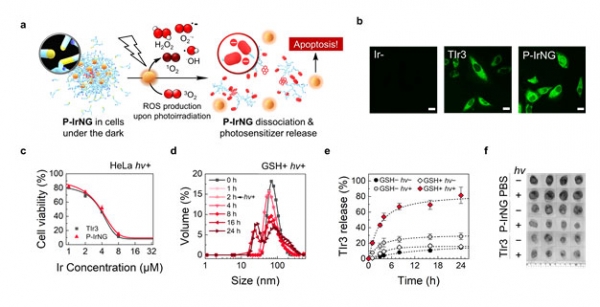
빛을 주면 나노젤 안에 담긴 광감각제에서 과량의 활성산소가 생성됐고, 활성산소는 티올을 비가역적(irreversible)으로 산화시켜 술폰산기(-SO3⊝)를 형성하므로 정전기적 척력에 의해 나노젤이 곧바로 분해된다. 결국 독성을 가지는 광감각제는 빛이 쪼여진 암세포에서만 활성화하는 것이다.
이번 연구로 그동안 효율이 매우 좋지만, 자체 독성으로 생체 내 적용이 어려웠던 광감각제의 응용범위를 넓히며, 수동적으로 분해돼 원하는 정확한 위치뿐만 아니라 원치 않는 정상세포에서도 분해됐던 이황화결합 기반 나노입자의 암 선택적 분해 능력을 높일 것으로 기대된다.
권태혁 교수는 "광감각제를 담은 나노젤의 분해를 빛과 암세포 내 환경을 이용해 시공간적으로 제어했다"며 "광감각제가 암만 골라 공격하도록 선택성을 높여 암 환자의 치료 부작용을 줄이는 중요한 분자공학적 전략이 될 것"이라고 설명했다.
포인트경제 이민준 기자
- 노보셀바이오, 항암치료신약 ‘NOVO-NK’ 임상시험 계획승인 신청
- 절박함 악용해 말기 암환자에 복어알 넣은 '복어추출액·환' 판매 적발
- 암치료 신약후보물질 'IDX-1197', FDA 임상시험계획 심사 통과
- 3상 임상 본격화하는 자가면역질환 치료제 바이오시밀러, 'CT-P43'
- 암 부위만 정확히 저격하는 새로운 표적 항암제 개발...진단·치료 동시 가능
- 스스로 빛 내는 단백질로 암세포 죽이는 암치료 기술 개발
- 암세포 타겟잡아서 치료한다...항암제 표적 단백질, 약물 전달체 'TNT'로 치료
- 표적 항암제 바이오시밀러 '베그젤마' 판매허가 획득한 셀트리온, 글로벌 시장 공략 본격화
- 새로운 표적 치료 약물 개발..."암세포 리소좀에 선택적 축적돼 암세포만 제거"

