기초과학연구원, RNA 연구단 김빛내리 교수 연구팀
질병 세포 단백질의 조절 기작 규명 기대

DNA로부터 유전자 정보가 옮겨진 유전체인 RNA와 결합하는 단백질 상에서 정확한 결합 부위를 찾을 수 있는 기법이 개발됐다.
기초과학연구원은 9일 RNA 연구단 김빛내리 교수 연구팀이 사람 세포 속 RNA 결합단백질 상에서 결합을 형성하는 'RNA 결합자리'를 광범위하고 정확하게 찾아낼 수 있는 기법을 개발했다고 밝혔다.
RNA 결합단백질은 유전자 발현을 조절하는 핵심인자로 질병과 세로 기능에 관련된 단백질의 조절 기작을 밝히는 데 기여할 것으로 기대된다.
RNA는 DNA에서 전사(옮기는 과정)된 유전자 정보를 번역해 단백질을 생산하는데, 전사되고 나서도 번역 효율, 안전성, 세포 내 위치 등 단백질 생산과정이 조절될 수 있다고 한다.
이런 전사 후 조절은 RNA 결합단백질이 RNA에 붙으면서 이뤄지고, 대부분의 단백질은 전사 후 조절을 거치면서 기능을 가지는데, 핵심 인자인 RNA 결합단백질과 RNA 사이 결합 원리와 상호작용은 거의 밝혀지지 않았다.
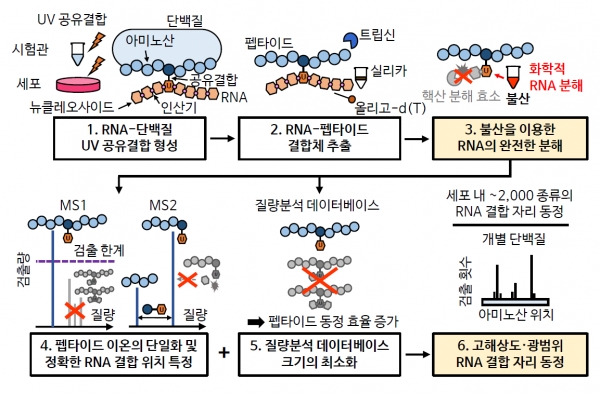
복잡한 단백질 구조에서 어느 조각이 결합자리인지조차 정확히 알 수 없었기 때문이라고 한다.
RNA 결합자리를 보기 위해서는 작은 단백질 조각의 질량을 측정해, 해당 조각을 구성하는 아미노산 및 단백질 내 위치를 추론하는 질량분석법을 사용한다.
RNA 결합단백질-RNA 결합체를 효소로 잘게 조개면 단백질 조각인 펩타이드에 RNA 조각이 붙은 형태가 된다. 이 질량 구성을 측정하고 RNA가 붙지 않은 펩타이드와 비교하면 RNA가 붙은 아미노산 자리는 그 질량만큼 차이가 나게 된다.
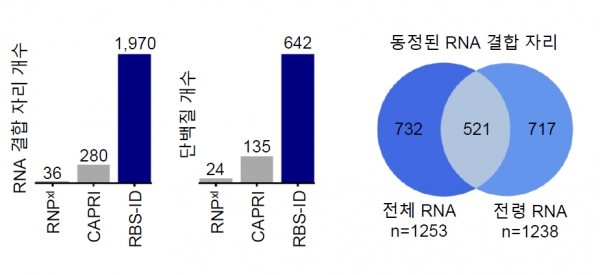
기존 연구에서 완전히 분해되지 않고 남아있는 RNA 조각 크기가 제각각이어서 질량 측정에 오차를 고려해야 했으나, 오차를 고려하고도 1천 개 이상 RNA 결합단백질에서 한 번에 수십~수백 개의 결합자리만 확인 가능했으며, 위치의 정확도도 떨어졌다고 한다.
효소 대신 '불산' 이용해 문제 해결
기초과학연구원 연구팀은 기존에 쓰이던 효소 대신 불산을 이용해 문제를 해결했다.
연구진은 불산이 DNA의 인산다이에스터 결합과 펩타이드에 결합한 인산을 분해한다는 선행 연구를 발견하였다. 이를 펩타이드에 결합한 RNA 분해에 활용하여 난관을 극복할 수 있었다고 한다.
불산은 RNA를 동일한 분자 한 개로 완전히 분해해, 한 번에 2천개 RNA 결합자리를 찾아낼 수 있었다. 불산 처리 후 RNA 조각의 질량을 쟀더니 동일한 유리딘 분자만 남음을 확인했으며, 조각의 질량 오차를 줄임으로써 결합자리를 더 많이 알아낼 수 있었다고 한다.
연구진에 따르면 세포 전체 RNA에 결합한 600개의 RNA 결합단백질 내에서 약 2천 종류 RNA 결합자리를 아미노산 수준의 고해상도로 찾아낼 수 있었다.
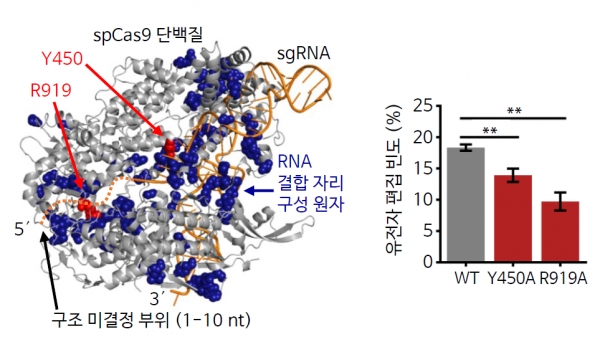
이렇게 찾은 RNA 결합자리를 바탕으로 연구진은 새로운 가설들을 제시했다. 먼저 질병 및 세포 기능에 중요한 단백질에서 RNA 결합자리를 다수 발견했다. 기존에 알려지지 않았던 RNA와의 결합이 각각 단백질의 기능을 조절할 수 있음을 시사한다. 또한 RNA 결합자리가 단백질의 공유결합 변형 자리와 비슷함도 보인 것은 결합력 조절 원리가 공유결합 변형일 수 있다는 뜻이라고 한다.
연구진은 "이번 규명으로 RNA-RNA 결합단백질 상호 작용을 세밀하게 연구할 수 있을 것으로 보이며, 이번 기술을 변형해 DNA와 결합하는 단백질로도 확장할 수 있으리라 기대된다"고 밝혔다.
포인트경제 박주현 기자

